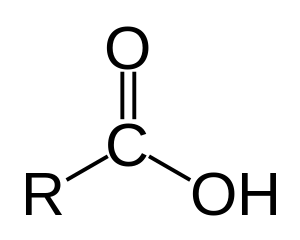
Axit cacboxylic là một loại axit hữu cơ chứa nhóm chức cacboxyl, có công thức tổng quát là R-C(=O)-OH, đôi khi được viết thành R-COOH hoặc R-CO2H trong đó R- là gốc hydrocarbon no hoặc không no.
Loại axit cacboxylic đơn giản nhất là no, đơn chức, ký hiệu R-COOH trong đó R- là gốc hydrocarbon thậm chí chỉ là 1 nguyên tử hydro.

Axit cacboxylic có phân cực và chứa liên kết hydro và phải tốn nhiều năng lượng mới có thể phá vỡ liên kết này nên nhiệt độ sôi của axit cao hơn hẳn rượu tương ứng. Ví dụ rượu etylic C2H5OH sôi ở 78,3 °C còn axit axetic CH3COOH sôi ở 118 °C.
Axit cacboxylic khá phổ biến trong tự nhiên và là một axit yếu. Trong môi trường nước nó bị phân li thành cation H+ và anion RCOO− nhưng với tỉ lệ rất thấp. Ví dụ, với nhiệt độ trong phòng thí nghiệm thì chỉ có 2% axit axetic bị phân li. Axit formic (HCOOH) là axit cacboxylic no, đơn chức mạnh nhất. Tính axit yếu dần từ axit axetic trở về sau do gốc Hydrocacbon làm giảm sự phân ly ion H+
- RCOOH ↔ RCOO- + H+
- Tính axit: làm đổi màu chất chỉ thị là quỳ tím thành đỏ hồng. Tác dụng với các kim loại hoạt động, các dung dịch bazơ và muối:
- CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
- 2CH3COOH + Mg → (CH3COO)2Mg + H2↑
- CH3COOH + CH3-CH2-OH ↔ CH3-C(O)-O-CH2-CH3 + H2O
- Muốn phản ứng xảy ra hoàn toàn cần có chất xúc tác là Axit sulfuric H2SO4 đặc để hút nước
- CH3-CH2-OH + O2 → CH3COOH + H2O
- C2H2 + H2O → CH3CHO (xúc tác Thủy ngân Sunfua 80 °C)
- CH3CHO + 1/2O2 → CH3COOH (xúc tác: Mn2+, nhiệt độ)
- Ngoài ra, có thể điều chế theo cách sau:
- Đầu tiên oxy hóa ancol:
- R-CH2-OH + O2 → R-CHO + H2O
- Sau đó oxy hóa tiếp anđehit thu được:
- R-CHO + [O] → R-COOH
Tên thông dụng của các axit cacboxylic thường được đặt theo tên của nguồn gốc tìm ra chúng như: axit formic,axit valeric,..
Danh sách một số Axit cacboxylic no đơn chức, mạch thẳng.
| Số nguyên tử Carbon | Tên thông dụng | Danh pháp IUPAC | Công thức cấu tạo | Thường có trong |
|---|---|---|---|---|
| 1 | Axit formic | Axit metanoic | HCOOH | Nọc của côn trùng (đặc biệt là kiến - formica) |
| 2 | Axit axetic | Axit etanoic | CH3COOH | Giấm ăn |
| 3 | Axit propionic | Axit propanoic | CH3CH2COOH | Các sản phẩm phân hủy của đường |
| 4 | Axit butyric | Axit butanoic | CH3(CH2)2COOH | Bơ ôi |
| 5 | Axit valeric | Axit pentanoic | CH3(CH2)3COOH | Cây nữ lang (Valeriana officinalis) |
| 6 | Axit caproic | Axit hexanoic | CH3(CH2)4COOH | Mỡ động vật, Vani |
| 7 | Axit enantoic | Axit heptanoic | CH3(CH2)5COOH | |
| 8 | Axit caprylic | Axit octanoic | CH3(CH2)6COOH | |
| 9 | Axit pelargonic | Axit nonanoic | CH3(CH2)7COOH | |
| 10 | Axit capric | Axit decanoic | CH3(CH2)8COOH | |
| 12 | Axit lauric | Axit dodecanoic | CH3(CH2)10COOH | Có nhiều trong dầu dừa |
| 18 | Axit stearic | Axit octadecanoic | CH3(CH2)16COOH | Có nhiều trong mỡ bò |
Axit axetic[sửa | sửa mã nguồn]
Axit axetic là nguyên liệu để tổng hợp polyme (Ví dụ như: polivinyl axetat, xenlulozơ axetat...), nông dược(thuốc diệt cỏ natri monocloaxetat, các chất kích thích tăng trưởng và làm rụng lá như 2,4-D; 2,4,5-T,...), công nghiệp nhuộm (nhôm axetat, crôm axetat, sắt axetat,...) và một số hóa chất hay dùng trong đời sống như axeton, etyl axetat, isoamyl axetat, v.v...
Dung dịch axit axetic 2-5% thu được khi lên men giấm cho dd đường, rượu etylic... dùng làm giấm ăn.
Axit lauric, axit panmitic, axit stearic và axit oleic[sửa | sửa mã nguồn]
Các axit lauric n-C11H23COOH, panmitic n-C15H31COOH, stearic n-C17H35COOH và oleic cis-CH3[CH2]7CH=CH[CH2]7COOH có trong thành phần dầu mỡ động vật và thực vật dưới dạng trieste của glixerol. Muối natri của chúng được dùng làm xà phòng. Các axit panmitic và stearic được trộn với parafin để làm nến.
Axit benzoic[sửa | sửa mã nguồn]
Axit benzoic (A. benzoic acid; cg. axit phenyl fomic, axit benzencacboxylic), C6H5COOH. Hợp chất thuộc loại axit cacboxylic thơm đơn giản nhất. Tinh thể hình kim hay hình vảy, màu trắng; tnc = 121,7 oC; ts = 249 oC; tthh = 100 oC. Tan trong dung môi hữu cơ và nước nóng. Điều chế bằng cách oxi hoá toluen bằng axit nitric hoặc axit cromic hoặc bằng oxi không khí (trong pha lỏng), đecacboxyl hoá anhiđrit phtalic trong pha khí ở 340 oC với chất xúc tác ZnO. Dùng để bảo quản thực phẩm, thuốc lá, keo dính; sản xuất phẩm nhuộm, dược phẩm và chất thơm. Trong y học, dùng làm thuốc sát trùng, diệt nấm.
Axit oxalic HOOC-COOH và axit manlonic HOOC-CH2-COOH[sửa | sửa mã nguồn]
- Axit oxalic khá phổ biến trong giới thực vật dưới dạng muối. Trong nước tiểu người và động vật có một lượng nhỏ canxi oxalat. Axit oxalic có tính khử; phản ứng oxi hóa axit oxalic thành CO2 nhờ tác dụng với KMnO4 được dùng trong hóa phân tích.
- Axit malonic chứa nhóm metylen linh động, dễ tham gia phản ứng ngưng tụ kiểu croton, mặt khác dễ bị decarboxyl hóa bởi nhiệt, sinh ra axit axetic. Este đietyl malonat CH2(COOC2H5)2 được dùng trong tổng hợp hữu cơ, đặc biệt là tổng hợp axit cacboxylic tăng 2 cacbon từ dẫn xuất halogen.
| Wikimedia Commons có thư viện hình ảnh và phương tiện truyền tải về Axit cacboxylic |
Comments
Post a Comment